Monitorowanie owulacji i wyznaczanie optymalnego terminu krycia u suk
Progesteron (P4)
W praktyce zastosowanie znajduje najczęściej oznaczanie stężenia progesteronu w surowicy krwi, które pozwala na oszacowanie dnia przedowulacyjnego piku LH. England i Concannon (9) zasugerowali, że progesteron w osoczu przekracza 2,0 ng/ml (6,5 nmol/l) (ryc. 1) w momencie wyrzutu LH bądź następnego dnia (9). Progesteron na początku fazy proestrus osiąga bardzo niskie wartości. Do końca tej fazy stężenie P4 w osoczu utrzymuje się na poziomie bazalnym (poniżej 0,5 nmol/l lub 0,16 ng/ml do 0,5 ng/ml, w zależności od badającego laboratorium i sprzętu) (1, 8, 9). Kolejno, fakt występowania przedowulacyjnej luteinizacji pęcherzyków przyczynia się do obserwowanego niewielkiego wzrostu stężenia progesteronu do około 2-3 ng/ml (6-9 nmol/l) w okresie towarzyszącym pikowi hormonu luteinizującego. W okresie okołoowulacyjnym stężenie P4 jest uznawane za względnie stałe i utrzymuje się na poziomie 4-10 ng/ml (15-24 nmol/l). W kolejnych dniach stężenie wzrasta z różną dynamiką do poziomu około 30-50 ng/ml (100-150 nmol/l) lub nawet wyższych (1, 8, 9).
Ze względu na to, że początkowy wzrost poziomu zachodzi progresywnie i jest obserwowany mniej więcej na 2 dni przed owulacją oraz osiąga wyraźnie wyższe wartości w czasie owulacji, jest to wysoce praktyczna metoda wyznaczania optymalnego terminu krycia u suk i monitorowania przebiegu cyklu płciowego. Powszechnie za optymalne uznaje się przeprowadzanie oznaczania poziomu progesteronu we krwi co 48-72 godziny w celu precyzyjnej oceny (1, 8, 10). Do oznaczania stężenia progesteronu zastosowanie mogą znaleźć: metoda radioimmunologiczna, metoda immunochemiluminescencyjna, a także oznaczenie ilościowe lub jakościowe za pomocą testu immunoenzymatycznego (ELISA). Przy wykorzystaniu komercyjnych testów opartych na metodzie ELISA, które umożliwiają ocenę jakościową bądź półilościową, wynik otrzymywany jest na podstawie zmiany kolorów w teście odzwierciedlających wzrost stężenia progesteronu we krwi (1, 8). Ta metoda cechuje się jednak mniejszą dokładnością w stosunku do oznaczenia ilościowego. Część autorów uznaje, że badania jakościowe nie są wystarczająco wiarygodne, aby znajdowały zastosowanie w praktyce (1, 8).
Gdy w pojedynczym oznaczeniu pozyskano wynik na poziomie kilkudziesięciu ng/ml, nie da się oszacować retrospektywnie momentu owulacji jedynie na podstawie takiego oznaczenia. Należy pamiętać, że wartości mierzone w surowicy krwi są zazwyczaj ok. 20% niższe niż wartości pozyskane podczas analizy osocza (8). Kolejnym istotnym faktem, jaki powinno się mieć na uwadze, jest to, że wartości progesteronu wahają się w ciągu dnia. Mogą być przeciętnie o 30% wyższe rano niż w godzinach popołudniowych (1, 8). Jak donosi m.in. Bogaerts, chłodzenie krwi pełnej przez dwie pierwsze godziny po pobraniu próbek wpływa na znaczne zmniejszenie otrzymywanych wyników wartości progesteronu (8). Z drugiej strony, jeżeli w ciągu pierwszych dwóch godzin po pobraniu probówka jest przechowywana w temperaturze pokojowej, a dopiero następnie schłodzona, uzyskiwane wartości pozostają stabilne (8).
Badanie cytologiczne nabłonka pochwy
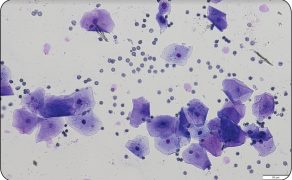
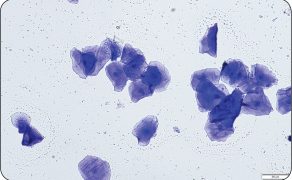
U suk błona śluzowa nabłonka pochwy jest pokryta nabłonkiem sześciennym (w anoestrus), przez fazę przejściową (w proestrus) po wielowarstwowy płaski rogowaciejący (w okresie płodnym) (1). Nabłonek w zależności od stopnia estrogenizacji ulega cyklicznym przemianom. Podczas proestrus i oestrus dochodzi do proliferacji komórek ściany pochwy, co najprawdopodobniej ma na celu ochronę śluzówki w czasie krycia (1, 11, 13). Ocena mikroskopowa komórek pobranych poprzez wymaz z pochwy u suk jest prostą i mało inwazyjną metodą monitorowania przebiegu cyklu jajnikowego, zwłaszcza jeżeli badanie jest wykonywane regularnie.
Zmiany stężenia 17β-estradiolu wpływają na cykliczne zmiany w obrębie nabłonka błony śluzowej pochwy właściwej, a analiza cytologiczna wymazów umożliwia pośrednio ocenę stopnia estrogenizacji układu rozrodczego oraz pozwala na ustalenie fazy cyklu płciowego (1, 11, 13). Badanie to polega na mikroskopowej ocenie proporcji pomiędzy różnymi rodzajami komórek nabłonka pochwy w preparatach, a interpretacja sprowadza się do oceny kształtu komórek nabłonkowych, stopnia ich degeneracji i keratynizacji, powinowactwa do barwników zasadowych lub kwaśnych oraz oceny pozostałych elementów obecnych w preparacie (13).
Najczęściej do pobierania materiału używa się wymazówki o końcówce zwilżonej płynem fizjologicznym. Srom przed rozpoczęciem pobierania materiału należy oczyścić i zdezynfekować, a następnie delikatnie oddzielić palcami wargi sromowe i wprowadzić wymazówkę przy grzbietowej części sromu (1, 11, 13-15). Aby uniknąć kontaminacji materiałem z innych miejsc niż pochwa, wskazane jest pobieranie materiału wykorzystaniem wziernika. Podczas wprowadzania i wyjmowania wymazówki wskazane jest unikanie okolicy dołu łechtaczkowego. Komórki pobrane z tej okolicy wykazują cechy zaawansowanej keratynizacji i mogą w prawidłowo pobranym materiale występować w niewielkiej ilości. Jednak w przypadku ich masowego występowania w preparacie mogą fałszować obraz, utrudniać interpretację, a nawet przyczynić się do postawienia mylnej diagnozy.
Dodatkowo w okolicy dołu łechtaczkowego znajdują się liczne bakterie, leukocyty, które także zaburzają obraz. Okolica ta jest bogato unerwiona i dość wrażliwa na dotyk, dlatego przy podrażnieniu bagietką może dojść do wytworzenia bodźca bólowego, po czym dalsze wykonywanie przy zwierzęciu czynności lekarsko-weterynaryjnych może być znacznie utrudnione bądź niemożliwe (1). Do badania cytologicznego wymazów pochwowych u suk wskazane jest pobieranie materiału z doogonowego odcinka pochwy właściwej (13, 16, 17). Wymazówkę należy wprowadzać pod kątem ok. 40-60° w stosunku do płaszczyzny horyzontalnej w kierunku doczaszkowo-dogrzbietowym, w kierunku kręgosłupa.
Po osiągnięciu dogrzbietowego obszaru błony śluzowej pochwy właściwej materiał jest pobierany poprzez delikatny obrót bagietki wokół własnej osi o pełen obrót w lewo lub prawo. Następnie należy ją wycofać z dróg rodnych, pamiętając o unikaniu okolicy dołu łechtaczkowego (13, 18). Kolejno przeprowadza się makroskopową ocenę wydzieliny, a następnie rozprowadza materiał z bagietki na szkiełko podstawowe poprzez przyłożenie i delikatne obracanie końcówki po szkiełku. Na szkiełku powstają 3-4 równoległe pasma nałożonego materiału. Następnie preparaty należy opisać, utrwalić i zabarwić. W literaturze opisano wiele metod barwienia preparatów (m.in. barwienie metodą Shora pozwalające na różnicowanie barwne komórek kwaso- i zasadochłonnych), ale w codziennej praktyce najczęściej stosuje się komercyjnie dostępne barwniki hematologiczne (13). Wskazane jest jednak nieco dłuższe barwienie preparatów cytologicznych w porównaniu z rozmazami krwi obwodowej (1, 3, 7).
Galeria
Mogą zainteresować Cię również
Znajdź swoją kategorię
2609 praktycznych artykułów - 324 ekspertów - 22 kategorii tematycznych
Weterynaria w Terenie

Ogólnopolski Dzień Koni
Koń od setek lat zajmował stałe miejsce w polskim krajobrazie, w polskim życiu, i w polskiej symbolice narodowej. Stanowił również symbol bogactwa, bowiem nie każdego było na niego stać. Zwierzęta te przez długi czas były popularnymi zwierzętami pociągowymi, pełniły też funkcje transportowe czy pracowały w gospodarstwach. Rozwój techniki zmienił jednak nieco rolę koni, we współczesnym […]

Podkliniczny niedobór wapnia i jego wpływ na wyniki rutynowych badań laboratoryjnych w różnych okresach laktacji u krów mlecznych
Rozpoznawanie choroby Wywiad W rozpoznawaniu pleuropneumonii duże znaczenie ma wywiad epizootiologiczny. Podejrzenie pleuropneumonii powinno być podjęte w przypadku stwierdzenia szybko rozprzestrzeniających się ostrych zachorowań z objawami ze strony układu oddechowego i nagłych padnięć warchlaków i tuczników o dobrej kondycji z objawami chorobowymi ze strony układu oddechowego i wyraźnego zasinienia skóry. Przy postaci chronicznej podejrzenie tej […]

Szerzenie się, profilaktyka i terapia ważnych ekonomicznie chorób układu oddechowego świń (pleuropneumonia, mykoplazmowe zapalenie płuc)
Profilaktyka nieswoista Stosowanie bodźcowych preparatów nieswoistych w sposób wyraźny wzmacnia siły obronne organizmu. Ostatnio wykazano zaskakująco dużą przydatność w stymulacji nieswoistej odporności świń znanego, aczkolwiek nie zawsze docenianego, od dawna wytwarzanego w Polsce produktu; jest nim Biotropina (Biowet Drwalew). Dwukrotne podanie tego biopreparatu prosiętom w okresie okołoodsadzeniowym w stopniu istotnym wzmacniało nieswoistą odpowiedź immunologiczną świń, […]

Wprowadzenie do stomatologii koni
Podczas badania klinicznego w pierwszej kolejności obserwujemy całą głowę, zwracając uwagę na jej poszczególne elementy (małżowiny uszne, oczy, kości czaszki, mięśnie, nozdrza), doszukując się w nich braku symetrii. Może być on powodowany deformacją kości czaszki, ich hipertrofią, chorobami neurologicznymi, zanikiem mięśni, obrzękiem tkanek miękkich. Podczas omacywania należy dokładnie sprawdzić okolicę stawu skroniowo-żuchwowego poprzez ucisk (ryc. […]
Wskazówki na wypadek widocznego niepowodzenia terapii antybiotykowej. Kryteria skutecznej terapii oraz kluczowe pytania jako 5 kroków drzewa analitycznego
Czynniki powiązane z użyciem antybiotyku w terapii: Czy wybór antybiotyku opierał się na badaniach klinicznych i dodatkowych (diagnoza, antybiogram)? Sprawdź odpowiedź na pytanie 3. Farmakokinetyka/farmakodynamika wybranego antybiotyku? Koncentracja i czas działania antybiotyku w zakażonej tkance a efektywność w stosunku do czynnika bakteryjnego wywołującego chorobę (spektrum działania antybiotyku, wrażliwość z antybiogramu – odpowiedzi na pytanie 3.). […]

Czarno na białym – mastitis okiem praktyka – rozmowa z dr. n. wet. Sebastianem Smulskim
Rozmowa z dr. n. wet. Sebastianem Smulskim, pracownikiem Uniwersytetu Przyrodniczego w Poznaniu, specjalistą w dziedzinie profilaktyki i leczenia mastitis u krów, który w swoich badaniach zgłębia tematykę zapalenia gruczołu mlekowego u bydła, zarówno w aspekcie naukowym, jak i praktycznym. Większość zapaleń gruczołu mlekowego ma etiologię bakteryjną. Dlaczego, pomimo rozwoju mikrobiologii, medycyny weterynaryjnej i prowadzonych badań, […]

XVIII FORUM ZOOTECHNICZNO-WETERYNARYJNE: NOWE HORYZONTY W ROZRODZIE ZWIERZĄT
Na Uniwersytecie Przyrodniczym w Poznaniu w dniach 18-19 kwietnia br. odbyło się XVIII Forum Zootechniczno-Weterynaryjne pod hasłem „Rozród zwierząt w dobie selekcji genomowej”. To wydarzenie zgromadziło liczne grono lekarzy weterynarii oraz hodowców, by omówić najnowsze osiągnięcia w dziedzinie hodowli i rozrodu zwierząt. Organizacja Forum była wspólnym przedsięwzięciem Poznańskiego Koła Polskiego Towarzystwa Zootechnicznego, Wielkopolskiego Oddziału Polskiego […]