Co to są leki weterynaryjne i jak jest regulowana ich obecność na rynku?
Do obrotu bez konieczności uzyskania pozwolenia dopuszczone są m.in.: leki recepturowe, apteczne, krew i osocze w pełnym składzie lub komórki krwi pochodzenia zwierzęcego, z wyłączeniem osocza przetwarzanego w procesie przemysłowym oraz immunologiczne produkty lecznicze weterynaryjne wytworzone z patogenów lub antygenów pochodzących od zwierząt znajdujących się w danym gospodarstwie i przeznaczonych do leczenia zwierząt występujących w tym samym gospodarstwie (tzw. autoszczepionki).
Weterynaryjny przemysł farmaceutyczny oferuje lekarzom weterynarii wiele produktów leczniczych weterynaryjnych. Zgodnie z informacjami dostępnymi w Urzędowym Wykazie Produktów Leczniczych Dopuszczonych do obrotu na terytorium Rzeczypospolitej Polskiej, dopuszczonych do obrotu na rynku polskim jest około 2000 produktów leczniczych weterynaryjnych. Większość dopuszczonych do obrotu produktów leczniczych dla zwierząt to antybiotyki, leki przeciwpasożytnicze oraz produkty immunologiczne.
Wszystkie zarejestrowane w Polsce produkty lecznicze mają określoną kategorię dostępności.
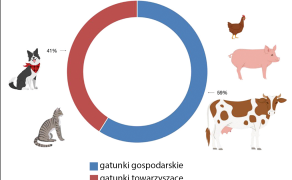
Około 40% dopuszczonych do obrotu leków jest przeznaczona do stosowania u zwierząt towarzyszących (pies, kot). Większość z tych produktów (około 80%) jest wydawana z przepisu lekarza weterynarii (Rp) i przeznaczona do stosowania wyłącznie przez lekarza weterynarii lub pod jego nadzorem. Tylko 20% stanowią produkty lecznicze posiadające kategorię dostępności OTC – produkty wydawane bez przepisu lekarza weterynarii, przeznaczone do stosowania przez właściciela lub opiekuna zwierzęcia.
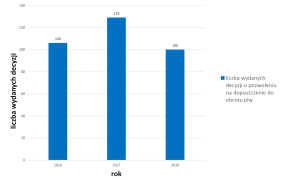
Od kilku lat obserwujemy pewnego rodzaju stabilizację, jeśli chodzi o liczbę wydanych decyzji o pozwoleniu na dopuszczenie do obrotu produktów leczniczych weterynaryjnych. W 2018 roku Prezes Urzędu wydał 100 nowych pozwoleń dla produktów leczniczych przeznaczonych dla zwierząt. Większość z tych produktów to leki przeciwinfekcyjne (28%), leki przeciwpasożytnicze, owadobójcze (20%), produkty immunologiczne (15%).
Zanim jednak produkt leczniczy weterynaryjny znajdzie się na rynku do stosowania przez lekarza weterynarii, musi przejść długą drogę rejestracyjną, naznaczoną wieloma szczegółowymi badaniami i testami. Średni czas trwania tego procesu to 8-10 lat do momentu dostarczenia zatwierdzonego produktu do odbiorcy. Na ten czas składają się prace nad stworzeniem nowego leku (2 lata), badania laboratoryjne, potwierdzające, czy lek działa (faza przedkliniczna – 3 lata), badania bezpieczeństwa i skuteczności u gatunków docelowych (faza kliniczna – 3 lata) oraz ocena dokumentacji złożonej przez podmiot odpowiedzialny, czyli przez właściciela produktu, do Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (2 lata).
Eksperci Urzędu (w przypadku procedur europejskich również eksperci ze wszystkich państw członkowskich Unii Europejskiej) oceniają stosunek korzyści związanej z użyciem leku do ryzyka, jakie ono niesie. Ocenę tę przeprowadza się w oparciu o przepisy prawa unijnego i krajowego, wytyczne europejskie oraz doświadczenie ekspertów. Postępowanie kończy się wydaniem przez Prezesa Urzędu pozwolenia i tym samym potwierdzeniem, że dopuszczony do obrotu produkt leczniczy weterynaryjny jest właściwej jakości (gdyż tylko takie leki są bezpieczne i skuteczne), skuteczny dla zwierząt (dla których został przeznaczony), bezpieczny dla zwierząt, człowieka oraz środowiska.
Galeria
Mogą zainteresować Cię również
Znajdź swoją kategorię
2608 praktycznych artykułów - 324 ekspertów - 22 kategorii tematycznych
Weterynaria w Terenie

Ogólnopolski Dzień Koni
Koń od setek lat zajmował stałe miejsce w polskim krajobrazie, w polskim życiu, i w polskiej symbolice narodowej. Stanowił również symbol bogactwa, bowiem nie każdego było na niego stać. Zwierzęta te przez długi czas były popularnymi zwierzętami pociągowymi, pełniły też funkcje transportowe czy pracowały w gospodarstwach. Rozwój techniki zmienił jednak nieco rolę koni, we współczesnym […]

Podkliniczny niedobór wapnia i jego wpływ na wyniki rutynowych badań laboratoryjnych w różnych okresach laktacji u krów mlecznych
Sposoby szerzenia się choroby Pleuropneumonia szerzy się drogą aerogenną od świni do świni, trzoda chlewna jest bowiem głównym rezerwuarem zarazka. Inne gatunki zwierząt, takie jak bydło czy owce, mogą być przypadkowymi nosicielami App, jednak nie odgrywają istotnej roli w szerzeniu się tego drobnoustroju. Jest prawdopodobne, że pewną rolę w epizootiologii omawianej jednostki chorobowej odgrywać mogą […]

Szerzenie się, profilaktyka i terapia ważnych ekonomicznie chorób układu oddechowego świń (pleuropneumonia, mykoplazmowe zapalenie płuc)
Zapobieganie Profilaktyka pleuropneumonii musi być wielokierunkowa. Biorąc pod uwagę fakt, że wystąpienie choroby w stadach wrażliwych na zakażenie wiąże się zazwyczaj z wprowadzeniem do chlewni pozornie zdrowych nosicieli App, zasadniczym elementem w ochronie takich stad jest serologiczna kontrola wszystkich świń wprowadzanych do chlewni. W przypadku wprowadzania do stada App serododatniego zwierząt wolnych od App celowe […]

Wprowadzenie do stomatologii koni
Sondy (ryc. 3) umożliwiają dokładne oczyszczanie szpar międzyzębowych oraz fizjologicznie lub niefizjologicznie występujących nieregularności zębów. Tarniki stanowią kluczowe narzędzie pracy lekarzy weterynarii, którzy w swojej ofercie mają zabieg odontoplastyki. Jeszcze do niedawna zastosowanie znajdowały jedynie tarniki ręczne, w obecnych czasach, ze względu na dużą dostępność i przystępną cenę, coraz częściej stosowane są tarniki mechaniczne (ryc. […]
Wskazówki na wypadek widocznego niepowodzenia terapii antybiotykowej. Kryteria skutecznej terapii oraz kluczowe pytania jako 5 kroków drzewa analitycznego
Czynniki powiązane z użyciem antybiotyku w terapii: Czy wybór antybiotyku opierał się na badaniach klinicznych i dodatkowych (diagnoza, antybiogram)? Sprawdź odpowiedź na pytanie 3. Farmakokinetyka/farmakodynamika wybranego antybiotyku? Koncentracja i czas działania antybiotyku w zakażonej tkance a efektywność w stosunku do czynnika bakteryjnego wywołującego chorobę (spektrum działania antybiotyku, wrażliwość z antybiogramu – odpowiedzi na pytanie 3.). […]

Czarno na białym – mastitis okiem praktyka – rozmowa z dr. n. wet. Sebastianem Smulskim
Rozmowa z dr. n. wet. Sebastianem Smulskim, pracownikiem Uniwersytetu Przyrodniczego w Poznaniu, specjalistą w dziedzinie profilaktyki i leczenia mastitis u krów, który w swoich badaniach zgłębia tematykę zapalenia gruczołu mlekowego u bydła, zarówno w aspekcie naukowym, jak i praktycznym. Większość zapaleń gruczołu mlekowego ma etiologię bakteryjną. Dlaczego, pomimo rozwoju mikrobiologii, medycyny weterynaryjnej i prowadzonych badań, […]

XVIII FORUM ZOOTECHNICZNO-WETERYNARYJNE: NOWE HORYZONTY W ROZRODZIE ZWIERZĄT
Na Uniwersytecie Przyrodniczym w Poznaniu w dniach 18-19 kwietnia br. odbyło się XVIII Forum Zootechniczno-Weterynaryjne pod hasłem „Rozród zwierząt w dobie selekcji genomowej”. To wydarzenie zgromadziło liczne grono lekarzy weterynarii oraz hodowców, by omówić najnowsze osiągnięcia w dziedzinie hodowli i rozrodu zwierząt. Organizacja Forum była wspólnym przedsięwzięciem Poznańskiego Koła Polskiego Towarzystwa Zootechnicznego, Wielkopolskiego Oddziału Polskiego […]