Bradykardia zatokowa u psów
Bradykardia paradoksalna i odruch Bezolda-Jarischa
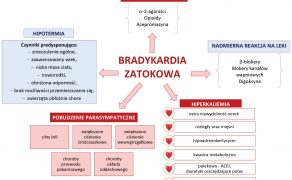
Bradykardia paradoksalna może pojawić się u psów podczas skomplikowanych procedur chirurgicznych w postaci odruchu Bezolda-Jarischa lub odwróconego odruchu Bainbridge’a (10). W praktyce klinicznej nie ma możliwości odróżnienia tych dwóch odruchów.
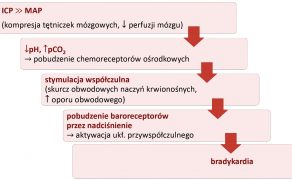
Odruch Bezolda-Jarischa (BJR, ang. Bezold-Jarisch reflex) jest aktywowany przez niedostateczne wypełnienie komór serca krwią i nie jest zależny od danej sytuacji czy zachowania, w odróżnieniu od odruchu wazowagalnego. Nazwa pochodzi od nazwisk jego odkrywców – odruch został po raz pierwszy zaobserwowany przez von Bezolda i Hirta w 1867 r. (49), a potwierdzony jako odruch nerwowy przez Jarischa i Richtera w 1939 r. (19). Pochodzi z aktywacji mechano- i /lub chemoreceptorów zlokalizowanych głównie w tylnej ścianie lewej komory serca (53), wywołanej na skutek mechanicznej stymulacji lub w odpowiedzi na substancje chemiczne, w tym leki [np. alkaloidy ciemiężycy białej, dopamina (45)].
Prowadzi do: bradykardii, rozkurczu obwodowych naczyń krwionośnych (niedociśnienia) i bezdechu. Jak dowiodły badania przeprowadzone przez zespół Oberga i in. (w latach 1970 i 1972 – 28-29) na kotach, za spadek częstości rytmu po intensywnym krwotoku (spadek rzutu o 40-50% stanowiący o utracie 30% objętości krwi) odpowiada właśnie BJR – nienormalnie zwiększona kurczliwość ścian serca wokół w zasadzie „pustych” komór pobudza ukryte w ścianie receptory, wywołując bradykardię (28, 29). U psów można spodziewać się opisanych zmian podczas długotrwałego znieczulenia ogólnego, szczególnie przy użyciu pochodnych fentanylowych, zmiany pozycji ciała zwierzęcia i przy współwystępującej hiperkapni. Zwykle czas trwania odruchu jest krótki, jednak w pojedynczych przypadkach może dojść do jego niebezpiecznego wydłużania się. Długotrwała reakcja zwiększa ryzyko powikłań pozabiegowych, dlatego też można podejmować próby przerwania odruchu przy użyciu atropiny (26).
Odruch Bainbridge’a natomiast opisał w 1915 r. angielski fizjolog Francis Arthur Bainbridge, który w badaniach na poddanych znieczuleniu ogólnemu psach zauważył, że podanie roztworu soli fizjologicznej zwiększa napór na ścianę przedsionków i prowadzi do wzrostu rytmu serca (HR), niezależnie od ciśnienia tętniczego krwi (2). Boettcher (5) zauważył, że wraz z postępem rozwoju filogenetycznego odruch ten traci u różnych gatunków na znaczeniu i zostaje w tyle wobec dominującego odruchu z baroreceptorów zatoki szyjnej, szczególnie przydatnych w kontroli parametrów krążenia podczas zmiany pozycji ciała (u psa odruch ten jest silniej wyrażony niż u człowieka) (5).
Obecnie odruch ten jest tłumaczony rozpieraniem ścian przedsionków przez zwiększoną objętość krwi (ang. preload), szczególnie prawego, a pośredniczą w nich baroreceptory zlokalizowane w ich ścianach i jego funkcja polega na adaptacji organizmu do wysiłku fizycznego. Przyczyną bradykardii jest odmienna reakcja, zwana odwróconym odruchem Bainbridge’a, wynikająca ze spadku napływu żylnego do jam serca w przypadkach znieczuleń nadoponowych lub niedociśnienia wywołanego u pacjentów podczas zabiegów chirurgicznych, w celu prewencji nadmiernej utraty krwi (9). Jatrogennie wywołana reakcja została opisana podczas zabiegu adrenalektomii u psa przy całkowitej, chwilowej okluzji ż. głównej doogonowej (10). Pacjent otrzymał również wcześniej remifentanyl, jako część protokołu anestetycznego, mogący być również czynnikiem sprzyjającym dla pojawienia się wspomnianego odruchu.
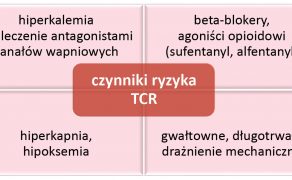
W 2018 r. pojawiło się również pierwsze jak dotąd doniesienie o zaobserwowanym u psa odruchu trójdzielno-sercowym (TCR, ang. trigeminocardiac reflex), który w medycynie człowieka jest uznawany za jeden z najsilniejszych odruchów autonomicznych wpływających na obniżenie częstości pracy serca. Stymulacja nerwu trójdzielnego na poziomie ośrodkowym lub obwodowym wywołuje negatywny efekt ino-, dromo- i chronotropowy (32).
W obrazie klinicznym dominują: zwolnienie akcji serca poniżej 60 bpm, zmniejszenie rzutu minutowego serca i spadek ciśnienia tętniczego krwi, średnio o 20%. Zmiany te wynikają z zahamowania automatyzmu węzła zatokowego na skutek wzrostu napięcia nerwu błędnego po podrażnieniu nerwu trójdzielnego (39). Szczególną uwagę na stabilizację hemodynamiczną pacjenta powinni zwrócić lekarze chirurdzy podczas manipulacji w obrębie twarzoczaszki na przebiegu gałęzi nerwu trójdzielnego (nerwu szczękowego, żuchwowego czy ocznego) czy na obszarze klatki piersiowej, np. podczas próby zamknięcia przetrwałego przewodu tętniczego (PDA, ang. patent ductus arteriosus) (30). W medycynie człowieka zidentyfikowano trzy grupy czynników ryzyka związane z odruchem trójdzielno-sercowym (ryc. 2).
Galeria
Mogą zainteresować Cię również
Znajdź swoją kategorię
2618 praktycznych artykułów - 324 ekspertów - 22 kategorii tematycznych
Weterynaria w Terenie

Przypadek zapalenia mózgu i mięśnia sercowego u prosiąt ssących
W przypadkach nagłych padnięć prosiąt przed odsadzeniem i tuczników zawsze można podejrzewać wystąpienie EMC. Problem może dotyczyć świń w każdym wieku, lecz najczęściej występuje u świń o wadze 60-70 kg. Rozpoznanie można postawić na podstawie wywiadu, występowania nagłych padnięć, charakterystycznych zmian sekcyjnych i mikroskopowych w sercu, a także izolacji EMCV w linii komórkowej BHK-21 lub […]

Podkliniczny niedobór wapnia i jego wpływ na wyniki rutynowych badań laboratoryjnych w różnych okresach laktacji u krów mlecznych
Sposoby szerzenia się choroby Pleuropneumonia szerzy się drogą aerogenną od świni do świni, trzoda chlewna jest bowiem głównym rezerwuarem zarazka. Inne gatunki zwierząt, takie jak bydło czy owce, mogą być przypadkowymi nosicielami App, jednak nie odgrywają istotnej roli w szerzeniu się tego drobnoustroju. Jest prawdopodobne, że pewną rolę w epizootiologii omawianej jednostki chorobowej odgrywać mogą […]

Przypadek zapalenia mózgu i mięśnia sercowego u prosiąt ssących
W przypadkach nagłych padnięć prosiąt przed odsadzeniem i tuczników zawsze można podejrzewać wystąpienie EMC. Problem może dotyczyć świń w każdym wieku, lecz najczęściej występuje u świń o wadze 60-70 kg. Rozpoznanie można postawić na podstawie wywiadu, występowania nagłych padnięć, charakterystycznych zmian sekcyjnych i mikroskopowych w sercu, a także izolacji EMCV w linii komórkowej BHK-21 lub […]

Choroby koni. Weterynaria praktyczna. Profilaktyka, rutynowe szczepienia
Publikacja stanowi fragment książki Choroby koni. Weterynaria praktyczna Wirus grypy jest wysoce zaraźliwy i szybko się rozprzestrzenia, a sama choroba niesie ze sobą bardzo poważne skutki i na długi czas wyklucza konia z udziału w zawodach czy wyścigach. Z tego względu wprowadzono wymóg obowiązkowych szczepień przeciwko grypie dla wszystkich koni wyścigowych oraz koni sportowych. Opory […]
Wskazówki na wypadek widocznego niepowodzenia terapii antybiotykowej. Kryteria skutecznej terapii oraz kluczowe pytania jako 5 kroków drzewa analitycznego
Czynniki powiązane z użyciem antybiotyku w terapii: Czy wybór antybiotyku opierał się na badaniach klinicznych i dodatkowych (diagnoza, antybiogram)? Sprawdź odpowiedź na pytanie 3. Farmakokinetyka/farmakodynamika wybranego antybiotyku? Koncentracja i czas działania antybiotyku w zakażonej tkance a efektywność w stosunku do czynnika bakteryjnego wywołującego chorobę (spektrum działania antybiotyku, wrażliwość z antybiogramu – odpowiedzi na pytanie 3.). […]

Czarno na białym – mastitis okiem praktyka – rozmowa z dr. n. wet. Sebastianem Smulskim
Rozmowa z dr. n. wet. Sebastianem Smulskim, pracownikiem Uniwersytetu Przyrodniczego w Poznaniu, specjalistą w dziedzinie profilaktyki i leczenia mastitis u krów, który w swoich badaniach zgłębia tematykę zapalenia gruczołu mlekowego u bydła, zarówno w aspekcie naukowym, jak i praktycznym. Większość zapaleń gruczołu mlekowego ma etiologię bakteryjną. Dlaczego, pomimo rozwoju mikrobiologii, medycyny weterynaryjnej i prowadzonych badań, […]

XVIII FORUM ZOOTECHNICZNO-WETERYNARYJNE: NOWE HORYZONTY W ROZRODZIE ZWIERZĄT
Na Uniwersytecie Przyrodniczym w Poznaniu w dniach 18-19 kwietnia br. odbyło się XVIII Forum Zootechniczno-Weterynaryjne pod hasłem „Rozród zwierząt w dobie selekcji genomowej”. To wydarzenie zgromadziło liczne grono lekarzy weterynarii oraz hodowców, by omówić najnowsze osiągnięcia w dziedzinie hodowli i rozrodu zwierząt. Organizacja Forum była wspólnym przedsięwzięciem Poznańskiego Koła Polskiego Towarzystwa Zootechnicznego, Wielkopolskiego Oddziału Polskiego […]