Receptory Toll w atopowym zapaleniu skóry
Każdy organizm żyjący, od samego początku, narażony jest na wpływ różnych patogenów. Po wniknięciu takiego patogenu do ustroju uruchamiana jest cała „armia” komórek układu odpornościowego, mająca na celu wyeliminowanie patogenu z organizmu.
Patogeny wykształciły w czasie rozwoju ewolucyjnego szereg mechanizmów „ucieczki” przed układem odpornościowym organizmu żywicielskiego. Te typy receptorów opisano stosunkowo niedawno, rzucają one światło na patogenezę różnych chorób, w tym atopowego zapalenia skóry. Jest wiadome, że komórki immunokompetentne rozpoznają charakterystyczne dla danego patogenu lub grupy tzw. PAMP (wzorce molekularne związane z patogenami).
Do tych wzorców należą m.in.:
- bakteryjny lipopolisacharyd,
- lipoproteiny,
- peptydoglikany,
- RNA wirusowe,
- niemetylowane sekwencje CpG (wyspy CpG),
- białka czy toksyny komórek bakteryjnych itp.
Te antygeny rozpoznaje się za pomocą tzw. PRR (receptory rozpoznające wzorce).
Grupy receptorów PRR (receptory rozpoznające wzorce) to:
- receptory wydzielane: opsoniny, białko wiążące mannozę, białka surfaktantu, białko C-reaktywne,
- r. powierzchniowe: receptory uczestniczące w procesie fagocytozy, integryny itp.,
- r. wewnątrzkomórkowe: receptory NOD-podobne, białka indukowane przez interferon itp.
Receptory Toll należą do tzw. receptorów przezbłonowych. W takim receptorze wyróżnia się: fragment zewnątrzkomórkowy, fragment śródbłonowy i fragment cytoplazmatyczny.
Fragment zewnątrzkomórkowy odpowiada za wiązanie z odpowiednim ligandem charakterystycznym dla danego receptora. Przekaz sygnału do komórki odbywa się z udziałem białek, m.in. My D88 (myeloid differentiantion factor 88) lub bez udziału tego białka. W czasie aktywacji receptora dochodzi do uaktywnienia czynnika transkrypcyjnego Nf-kb (ang. nuclear factor kappa beta), a on wpływa na syntezę cytokin i chemokin, uczestniczących w reakcjach immunologicznych.
Receptory Toll i ich funkcje
W budowie patogenów, w ich wewnętrznej/zewnętrznej strukturze, znajdują się pewne ich fragmenty odpowiedzialne za wzmacnianie odpowiedzi immunologicznej przeciwko nim. Są to tzw. PAMP (wzorce molekularne związane z patogenami). Rozpoznaje się za pomocą receptorów PRR na komórkach układu odpornościowego jako tzw. receptory Toll.
Zaktywowane komórki, poprzez receptory Toll, syntetyzują wiele różnych cytokin czy chemokin odpowiedzialnych za napływ komórek układu odpornościowego – limfocytów, makrofagów, komórek tucznych, komórek dendrytycznych itp. – do ogniska rozwijającego się zapalenia.
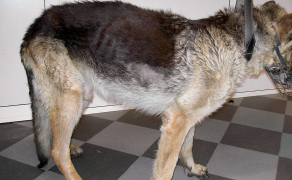
Makrofagi, w wyniku aktywacji przez wspomniane receptory, zwiększają ekspresję MHC klasy II i MHC klasy I. Proces prezentowania antygenów jest bardziej swoisty oraz obserwowana jest indukcja swoistej odpowiedzi immunologicznej, a także aktywacja limfocytów T. Stwierdzono, że brak receptorów TLR2, TLR4 obecnych na makrofagach, jak i białka My88, powoduje opóźnioną fagocytozę bakterii, m.in. Staphylococcus aureus, co przedkłada się na zwiększoną kolonizację skóry przez tę bakterię obserwowaną w atopowym zapaleniu skóry tak u ludzi, jak i u zwierząt (9-17).
Komórki dendrytyczne
Te komórki są jednym z pierwszych etapów, jakie obserwuje się w rozwoju reakcji alergicznej. Stwierdzono, że komórki dendrytyczne (Dendritic Cells, DC) „niedojrzałe” mają właściwości pinocytarne, a po dojrzeniu – zdolność do prezentowania antygenu (aktywacja receptorów TLR przez PAMP). Zaktywowane komórki DC syntetyzują różne cytokiny prozapalne, m.in.: IL-6, IL-12, IL-18 i TNF (8).
Komórki DC po rozpoznaniu antygenu migrują do regionalnych węzłów chłonnych, gdzie w obecności receptorów chemokinowych (CCR5, CCR7 itp.) ma miejsce aktywacja limfocytów T. Dochodzi do polaryzacji limfocytów w kierunku Th2 i syntezy cytokin nasilających proces alergiczny. Ale stwierdzono fakt przeczący tej teorii, mówiący o tym, że komórki dendrytyczne mogą również hamować rozwój reakcji alergicznej (TLR2, TLR4) (8).
Komórki tuczne (mastocyty)
Zlokalizowane są wokoło naczyń krwionośnych, pod błoną śluzową, aktywowane przez TLR1, TLR2, TLR4, TL 6, TLR9, syntetyzują prostaglandyny, leukotrieny, histaminę, odpowiedzialne za rozwój procesu zapalnego.
Obserwowane coraz liczniej objawy alergii tak u ludzi, jak i u zwierząt stanowią poważny problem na całym świecie. U podstawy tych schorzeń upatruje się zaburzeń w układzie immunologicznym chorego osobnika i wpływ środowiska na pojawienie się tych schorzeń.
W atopowym zapaleniu skóry stwierdzono przesunięcie równowagi pomiędzy limfocytami Th1a Th2 na korzyść TH2. Limfocyty Th2 syntetyzują cytokiny prozapalne, m.in. IL-4, i są one odpowiedzialne za zwiększoną syntezę IgE, a co za tym idzie – nasilenie klinicznych objawów alergii. Musi zostać rozpatrzony pogląd odnośnie do tego przesunięcia w kierunku Th2, gdyż w modelu Th1 zależnej reakcji nadwrażliwości kontaktowej jest potrzebna IL-4, zaburzona synteza IL-12/INF gamma, nie ma związku ze zwiększoną częstotliwością występowania alergii, a także trzeci sygnał, mówiący o tym, że przy zarażeniu pasożytami przewodu pokarmowego (indukowanie odpowiedzi zależnej od Th2) obserwuje się obniżenie objawów klinicznych alergii.
Do głosu dochodzą również limfocyty T reg. i ich udział w odpowiedzi na alergen. Głównym zadaniem tych komórek jest „podjęcie decyzji”, czy wzbudzać odpowiedź na alergen, czy nie. Ten typ limfocytów jest odpowiedzialny za utrzymanie homeostazy układu odpornościowego w organizmie, hamowanie patologicznych i fizjologicznych reakcji układu odpornościowego.
Limfocyty T reg. uczestniczą również w ważnym procesie, m.in. kiedy doprowadzić do „wygaśnięcia” ogniska zapalnego. W atopowym zapaleniu skóry te ogniska procesów patologicznych, toczących się w skórze przez długi czas. Doprowadzają do zmian w jej strukturze, do trwałego jej uszkodzenia. W czasie przewlekle trwających infekcji cytokina IL-6 blokuje supresyjne działanie limfocytów T reg. w stosunku do autoreaktywnych limfocytów.
Jest to jeden z czynników patognomicznych w rozwoju chorób o podłożu autoimmunologicznym. U osób z mutacją w genie Fox P3 (czynnik transkrypcyjny) obserwowana jest znikoma zachorowalność na alergie, co by sugerowało wpływ tego genu na patogenezę rozwoju alergii.
Jednak stwierdzono również znaczący wpływ na limfocyty T reg., jaki wywiera tzw. flora komensaliczna bytująca w organizmie. Zmiany w składzie owej flory – powodowane m in. przez brak stymulacji receptorów TLR przez drobnoustroje zupełnie nieszkodliwe dla człowieka (tzw. hipoteza higieniczna) – upośledzają w jakiś sposób prawidłowe funkcjonowanie limfocytów T reg. (1-5).
Wiadomo o protekcyjnym wpływie TLR na funkcje komórek układu odpornościowego i co za tym idzie – na rozwój alergii. Mianowicie wczesna, niezaburzona stymulacja receptorów TLR przez mikroby komensaliczne wpływa stymulująco na funkcjonowanie komórek dendrytycznych, a co za tym idzie – na wytworzenie równowagi pomiędzy limfocytami Th1 a Th2.
Obserwowany jest również hamujący wpływ limfocytów T reg. na zbyt nasiloną odpowiedź na alergen w komórkach prezentujących antygen (APC), limfocytach Th1, Th2, eozynofilach, mastocytach, w wyniku czego dochodzi do obniżenia syntezy IgE.
W przypadku stymulacji receptora TLR 3 przez wirusowe czynniki infekcyjne (wirusy atakujące drogi oddechowe i wpływające na zaostrzenie przebiegu astmy to wirus RSV, rhinowirus, wirus grypy, paragrypy itp.) obserwuje się nasilenie rozwoju zapalenia alergicznego. Stwierdzono, że pochodząca limfopoetyna ze zrębu grasicy (TLSP) jest odpowiedzialna za indukowanie reakcji alergicznej (nadmiernej) przez wpływ na niedojrzałe komórki dendrytyczne, co stymuluje je do syntezy IL-8, eotaksyny, chemokin wykazujących właściwości przyciągania komórek biorących udział w reakcji zapalnej – makrofagów, eozynofili, limfocytów Th2, a co za tym idzie – do rozwoju ogniska zapalnego. To zostało stwierdzone w laboratorium. Potrzebne są dalsze badania, by ten pogląd zweryfikować.
Brak prawidłowo reagujących receptorów TLR2 może nasilać objawy kliniczne atopii. Stwierdzono fakt, że polimorfizmy w tym receptorze są odpowiedzialne za różne postacie kliniczne atopowego zapalenia skóry. W receptorze TLR2 zidentyfikowano polimorfizm w regionie promotorowym genu, co prowadzi do obniżonej ekspresji tego białka, a co za tym idzie – zwiększoną podatność na zakażenia, m.in. powodowane przez Staphylococcus aureus.
W receptorze TLR4 również znaleziono polimorfizm, wpływający na obniżenie odpowiedzi na bakteryjny lipopolisacharyd (LPS), obniżoną gęstość receptora na nabłonku dróg oddechowych u ludzi z astmą i obniżoną produkcją różnych cytokin prozapalnych. Te informacje potwierdzają pogląd odnośnie do wpływu środowiska na odpowiedź immunologiczną, a także na jej modyfikację (6, 7, 9).
Wydaje się zasadne, by korzystać z natury (produkty spożywcze nabywać w gospodarstwach ekologicznych, ulokowanych z dala od miast), a także psu podawać karmę przygotowaną z takich składników, urozmaiconą, i ograniczyć stosowanie leków i środków chemicznych do niezbędnego minimum.
Piśmiennictwo dostępne w redakcji
lek. wet. Maciej Kucharski
Gabinet Weterynaryjny „Wetaxus” w Brwinowie
Mogą zainteresować Cię również
Znajdź swoją kategorię
2608 praktycznych artykułów - 324 ekspertów - 22 kategorii tematycznych
Weterynaria w Terenie

Podkliniczny niedobór wapnia i jego wpływ na wyniki rutynowych badań laboratoryjnych w różnych okresach laktacji u krów mlecznych
Title Swine pleuropneumonia – diagnostics and management Streszczenie Obserwacje epizootiologiczne oraz wyniki badań klinicznych, anatomopatologicznych i laboratoryjnych prowadzonych w chlewniach średnio- i wielkotowarowych, w których stwierdzano nagłe zachorowania – z ostrymi objawami ze strony układu oddechowego, przede wszystkim wśród warchlaków i tuczników – wskazują, że ich przyczyną dość często bywa pleuropneumonia świń. Czynnikiem etiologicznym tej […]

Podkliniczny niedobór wapnia i jego wpływ na wyniki rutynowych badań laboratoryjnych w różnych okresach laktacji u krów mlecznych
Title Swine pleuropneumonia – diagnostics and management Streszczenie Obserwacje epizootiologiczne oraz wyniki badań klinicznych, anatomopatologicznych i laboratoryjnych prowadzonych w chlewniach średnio- i wielkotowarowych, w których stwierdzano nagłe zachorowania – z ostrymi objawami ze strony układu oddechowego, przede wszystkim wśród warchlaków i tuczników – wskazują, że ich przyczyną dość często bywa pleuropneumonia świń. Czynnikiem etiologicznym tej […]

Szerzenie się, profilaktyka i terapia ważnych ekonomicznie chorób układu oddechowego świń (pleuropneumonia, mykoplazmowe zapalenie płuc)
Streszczenie Pleuropneumonia i mykoplazmowe zapalenie płuc są chorobami układu oddechowego świń, które wywołują szczególnie duże straty ekonomiczne. Rozpoznawanie wymienionych chorób jest stosunkowo proste. Profilaktyka oparta jest na stosowaniu szczepionek. W Polsce dostępnych jest wiele szczepionek przeciwko MPS oraz kilka biopreparatów przeciwko App. Ich efektywność jest zróżnicowana i zależna od właściwości szczepów wywołujących choroby oraz składu […]

Wprowadzenie do stomatologii koni
Streszczenie Stomatologia koni jest dziedziną medycyny weterynaryjnej, w której nadal jest więcej pytań niż odpowiedzi. Jednak ze względu na dynamiczny jej rozwój, a także rosnącą świadomość właścicieli koni oraz profesjonalistów zajmujących się ich obsługą i treningiem zapotrzebowanie na usługi z tego obszaru stale rośnie. Wychodząc naprzeciw oczekiwaniom klientów, lekarze weterynarii specjalizujący się w stomatologii koni […]
Wskazówki na wypadek widocznego niepowodzenia terapii antybiotykowej. Kryteria skutecznej terapii oraz kluczowe pytania jako 5 kroków drzewa analitycznego
Analiza oceny przypadków klinicznych przy podejrzeniu braku skuteczności działania antybiotyków. Jak powinno wyglądać drzewo decyzyjne i na jakie pytania należy podczas takiej analizy odpowiedzieć? Co zrobić, aby zwiększyć skuteczność terapii? Czasem wystarczy tylko odpowiedzieć na kilka prostych pytań. Z punktu widzenia hodowcy główne kryteria oceny terapii przeciwbakteryjnej to wyraźne złagodzenie, a następnie ustąpienie objawów klinicznych […]

Czarno na białym – mastitis okiem praktyka – rozmowa z dr. n. wet. Sebastianem Smulskim
Rozmowa z dr. n. wet. Sebastianem Smulskim, pracownikiem Uniwersytetu Przyrodniczego w Poznaniu, specjalistą w dziedzinie profilaktyki i leczenia mastitis u krów, który w swoich badaniach zgłębia tematykę zapalenia gruczołu mlekowego u bydła, zarówno w aspekcie naukowym, jak i praktycznym. Większość zapaleń gruczołu mlekowego ma etiologię bakteryjną. Dlaczego, pomimo rozwoju mikrobiologii, medycyny weterynaryjnej i prowadzonych badań, […]

XVIII FORUM ZOOTECHNICZNO-WETERYNARYJNE: NOWE HORYZONTY W ROZRODZIE ZWIERZĄT
Na Uniwersytecie Przyrodniczym w Poznaniu w dniach 18-19 kwietnia br. odbyło się XVIII Forum Zootechniczno-Weterynaryjne pod hasłem „Rozród zwierząt w dobie selekcji genomowej”. To wydarzenie zgromadziło liczne grono lekarzy weterynarii oraz hodowców, by omówić najnowsze osiągnięcia w dziedzinie hodowli i rozrodu zwierząt. Organizacja Forum była wspólnym przedsięwzięciem Poznańskiego Koła Polskiego Towarzystwa Zootechnicznego, Wielkopolskiego Oddziału Polskiego […]