Nowe technologie w diagnostyce parazytologicznej – automatyzacja w badaniu kału
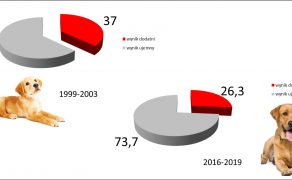
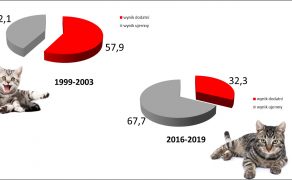
Inwazje pasożytów wewnętrznych psów i kotów to wciąż aktualny problem zarówno w krajach rozwijających się, jak i w krajach rozwiniętych, w których opieka weterynaryjna i profilaktyka przeciwpasożytnicza stoją na wysokim poziomie. Potwierdzają to wyniki badań parazytologicznych kału zwierząt towarzyszących w Europie, według których ogólna ekstensywność inwazji pasożytów przewodu pokarmowego waha się od kilku do kilkudziesięciu procent w zależności od wieku badanych osobników, sposobu utrzymania, a także użytych metod diagnostycznych (6, 10). Do podobnych wniosków można dojść, analizując dane krajowe. Co prawda porównanie wyników badań koproskopowych wykonanych w Zakładzie Parazytologii i Chorób Inwazyjnych Uniwersytetu Przyrodniczego w Lublinie w latach 1999-2003 i 2016-2021 wykazało spadek ogólnej ekstensywności inwazji pasożytów wewnętrznych u psów i kotów z poziomów odpowiednio 37% i 57,9% do 26,3% i 32,3%, to jednak dane te są zaskakująco wysokie, biorąc pod uwagę obserwowany w Polsce postęp parazytologii weterynaryjnej i wzrastającą świadomość właścicieli zwierząt (ryc. 1 i 2).
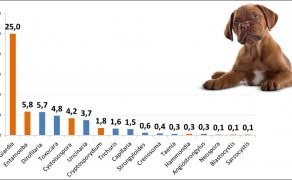
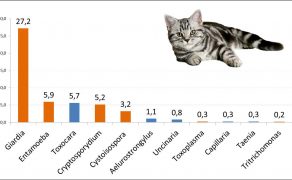
Pewnym wytłumaczeniem może być bardziej szczegółowa analiza danych inwazjologicznych z ostatnich lat (ryc. 3 i 4). Wynika z niej, że regularna i powszechna profilaktyka przeciwpasożytnicza psów i kotów ograniczyła występowanie helmintów, jednak stale wzrasta znaczenie protoparazytoz jelitowych wywoływanych przez rodzaje: Giardia, Cryptosporidium, Cystoisospora, Entamoeba, w przypadku których standardowe schematy odrobaczania z wykorzystaniem preparatów zawierających antyhelmintyki są nieskuteczne (10-12). Dlatego też wciąż podkreśla się rolę i znaczenie inwazjologiczne rutynowych badań parazytologicznych kału zwierząt, dzięki którym postępowanie przeciwpasożytnicze może być ukierunkowane na czynnik etiologiczny inwazji. Według zaleceń CAPC (Companion Animals Parasite Concil) oraz ESCCAP (European Scientific Council Companion Animal Parasites) badanie kału należy wykonywać w zależności od stanu zdrowia pacjenta i czynników ryzyka związanych z jego stylem życia, minimum cztery razy w pierwszym roku życia zwierzęcia i co najmniej dwukrotnie w roku u osobników dorosłych (4).
Klasyczne metody badania kału
Badania mikroskopowe kału stanowią integralną część diagnostyki medycznej i weterynaryjnej. Pozwalają one wykryć inwazje pasożytów przewodu pokarmowego, dróg żółciowych, nematodozy układu oddechowego. Pełne badanie parazytologiczne kału powinno obejmować badanie makroskopowe – pozwalające wykryć pojedyncze człony maciczne i elementy strobili tasiemców, dorosłe postaci nicieni, np. rodzajów Toxocara, Toxascaris, oraz badanie mikroskopowe z wykorzystaniem różnych modyfikacji metod rozmazu, flotacji, sedymentacyji i metod larwoskopowych jak metoda Baermanna.
Cennym uzupełnieniem klasycznej diagnostyki mikroskopowej są testy immunochromatograficzne wykrywające koproantygeny pierwotniaków jelitowych, testy ELISA, IFA i badania PCR. Spośród metod mikroskopowych najczęściej zlecanym badaniem parazytologicznym kału w praktyce zwierząt towarzyszących jest metoda flotacji, która w zależności od modyfikacji i użytego płynu flotacyjnego pozwala stwierdzić w badanych próbkach kału oocysty kokcydiów, cysty pierwotniaków z rodzaju Giardia, większość jaj nicieni oraz część jaj tasiemców, a także niektórych przywr. Biorąc pod uwagę dwa parametry: czułość (liczba próbek fałszywie ujemnych) i wydajność (procent wykrytych jaj w badanym materiale), w większości diagnostycznych laboratoriów weterynaryjnych na całym świecie największe znaczenie przypisuje się metodzie flotacji z wirowaniem.
Metoda ta jest uważana za „złoty standard”, ponieważ charakteryzuje się lepszymi wskaźnikami wykrywania pasożytów niż flotacja bierna, która jest z kolei najczęściej wykonywanym badaniem kału w lecznicach weterynaryjnych. Wykazano, że odwirowanie próbek kału w roztworze sacharozy Sheathera (ciężar właściwy 1,27) pozwala „odzyskać” od 3 do 5 razy więcej jaj pasożytów z badanego materiału w porównaniu z klasyczną metodą Fülleborna z użyciem roztworu nasyconego NaCl (ciężar właściwy: 1,18-1,2) lub komercyjnymi zestawami do flotacji wykorzystującymi roztwór nasycony NaNO3 (ciężar właściwy: 1,18). Zalety wymienionych metod mikroskopowych to: stosunkowo mała kosztochłonność, szybki czas oznaczenia, niewielkie wymogi techniczne zaplecza laboratoryjnego i związana z tym szeroka dostępność wykonania tych badań. Z drugiej strony ograniczeniem klasycznych metod koproskopowych jest ich stosunkowo niska czułość w porównaniu do metod immunologicznych czy molekularnych.
Galeria
Mogą zainteresować Cię również
Znajdź swoją kategorię
2608 praktycznych artykułów - 324 ekspertów - 22 kategorii tematycznych
Weterynaria w Terenie

Ogólnopolski Dzień Koni
Koń od setek lat zajmował stałe miejsce w polskim krajobrazie, w polskim życiu, i w polskiej symbolice narodowej. Stanowił również symbol bogactwa, bowiem nie każdego było na niego stać. Zwierzęta te przez długi czas były popularnymi zwierzętami pociągowymi, pełniły też funkcje transportowe czy pracowały w gospodarstwach. Rozwój techniki zmienił jednak nieco rolę koni, we współczesnym […]

Podkliniczny niedobór wapnia i jego wpływ na wyniki rutynowych badań laboratoryjnych w różnych okresach laktacji u krów mlecznych
Obserwacje epizootiologiczne oraz wyniki badań klinicznych, anatomopatologicznych i laboratoryjnych prowadzonych w chlewniach średnio- i wielkotowarowych, w których stwierdzano nagłe zachorowania – z ostrymi objawami ze strony układu oddechowego, przede wszystkim wśród warchlaków i tuczników – wskazują, że ich przyczyną dość często bywa pleuropneumonia świń. Czynnikiem etiologicznym tej choroby są drobnoustroje Actinobacillus pleuropneumoniae (App). Cechą charakterystyczną […]

Szerzenie się, profilaktyka i terapia ważnych ekonomicznie chorób układu oddechowego świń (pleuropneumonia, mykoplazmowe zapalenie płuc)
Choroby układu oddechowego świń są ważnym problemem zdrowotnym i – w konsekwencji – ekonomicznym w chowie świń. Przyczyny wysunięcia się tej grupy chorób na czoło problemów zdrowotnych to, przede wszystkim, mająca miejsce w Europie około 30 lat temu zmiana systemu chowu świń z drobnotowarowego na średnio- i wielkotowarowy oraz potęgujący się z roku na roku […]

Wprowadzenie do stomatologii koni
Problemy stomatologiczne i wynikające z ich obecności przeszkody w prawidłowym użytkowaniu koni są jedną z częstszych przyczyn interwencji lekarzy weterynarii specjalizujących się w tej dziedzinie. Dowiedziono, że po diagnostyce kulawizn, szczepieniach, diagnostyce i leczeniu chorób układu rozrodczego, badanie przed kupnem/sprzedażą zajmuje najwięcej czasu praktykującym lekarzom weterynarii (1). Ewolucyjna droga od żyjącego we wczesnym Eocenie Hyracotherium […]
Wskazówki na wypadek widocznego niepowodzenia terapii antybiotykowej. Kryteria skutecznej terapii oraz kluczowe pytania jako 5 kroków drzewa analitycznego
Czynniki powiązane z użyciem antybiotyku w terapii: Czy wybór antybiotyku opierał się na badaniach klinicznych i dodatkowych (diagnoza, antybiogram)? Sprawdź odpowiedź na pytanie 3. Farmakokinetyka/farmakodynamika wybranego antybiotyku? Koncentracja i czas działania antybiotyku w zakażonej tkance a efektywność w stosunku do czynnika bakteryjnego wywołującego chorobę (spektrum działania antybiotyku, wrażliwość z antybiogramu – odpowiedzi na pytanie 3.). […]

Czarno na białym – mastitis okiem praktyka – rozmowa z dr. n. wet. Sebastianem Smulskim
Rozmowa z dr. n. wet. Sebastianem Smulskim, pracownikiem Uniwersytetu Przyrodniczego w Poznaniu, specjalistą w dziedzinie profilaktyki i leczenia mastitis u krów, który w swoich badaniach zgłębia tematykę zapalenia gruczołu mlekowego u bydła, zarówno w aspekcie naukowym, jak i praktycznym. Większość zapaleń gruczołu mlekowego ma etiologię bakteryjną. Dlaczego, pomimo rozwoju mikrobiologii, medycyny weterynaryjnej i prowadzonych badań, […]

XVIII FORUM ZOOTECHNICZNO-WETERYNARYJNE: NOWE HORYZONTY W ROZRODZIE ZWIERZĄT
Na Uniwersytecie Przyrodniczym w Poznaniu w dniach 18-19 kwietnia br. odbyło się XVIII Forum Zootechniczno-Weterynaryjne pod hasłem „Rozród zwierząt w dobie selekcji genomowej”. To wydarzenie zgromadziło liczne grono lekarzy weterynarii oraz hodowców, by omówić najnowsze osiągnięcia w dziedzinie hodowli i rozrodu zwierząt. Organizacja Forum była wspólnym przedsięwzięciem Poznańskiego Koła Polskiego Towarzystwa Zootechnicznego, Wielkopolskiego Oddziału Polskiego […]