Koronawirusy patogenne dla trzody chlewnej – wirus zakaźnego zapalenia żołądka i jelit
Odporność
Jak wspomniano we wcześniejszej części artykułu, zakażenie PRCV zapewnia częściową odporność przeciwko TGEV, co doprowadziło do zmniejszenia znaczenia klinicznego TGE w wielu krajach. Częściowa odporność jest indukowana przez szybki wzrost miana przeciwciał neutralizujących po narażeniu na TGEV oraz wzrost liczby komórek syntetyzujących immunoglobuliny klasy G (IgG) i A (IgA) w tkance jelit u świń wcześniej zakażonych PRCV (42-44).
Świnie, które przeszły TGE, są odporne przez krótki okres na ponowne zakażenie dzięki lokalnej odporności błon śluzowych i swoistym sekrecyjnym IgA wytwarzanym przez komórki błony śluzowej jelit (42, 44-46). Na czas trwania odporności mają wpływ wiek i status immunologiczny zwierzęcia w momencie pierwotnej infekcji (47). Lochy przekazują nowo narodzonym prosiętom przeciwciała neutralizujące TGEV, zapewniając w ten sposób kluczową w pierwszych dniach życia prosiąt bierną odporność laktogenną, która zabezpiecza przez zakażeniem ogólnoustrojowym (3, 48). Najbardziej efektywną ochronę zapewniają IgA powstające po infekcji drogą pokarmową. Przeciwciała IgA i IgG (szczególnie IgA) wytworzone po reinfekcji loch ciężarnych PRCV zapewniają również ochronę prosiąt przed negatywnymi konsekwencjami TGEV (7).
Diagnostyka
Dodatkowe badania laboratoryjne są niezbędne do potwierdzenia podejrzenia TGE, ponieważ objawy kliniczne i zmiany anatomopatologiczne nie pozwalają na postawienie ostatecznego rozpoznania. W diagnostyce różnicowej należy uwzględnić inne patogeny wykrywane u młodych prosiąt, m.in. PEDV, rotawirusy czy Escherichia coli (7). Materiałem wykorzystywanym w diagnostyce mogą być: zwłoki świeżo padłych prosiąt, wycinki jelit lub zeskrobiny pobrane z błony śluzowej jelita czczego albo krętego, kał lub surowica (33).
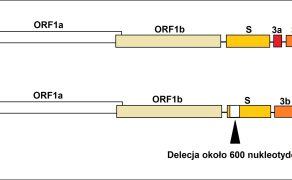
Najczęściej wykorzystywaną metodą diagnostyczną jest wykrywanie materiału genetycznego TGEV za pomocą metody RT-PCR lub RT-PCR w czasie rzeczywistym. W tym celu najlepiej pobrać próbki kału od zwierząt, które uległy zakażeniu 2-7 dni wcześniej. Metoda ta pozwala na odróżnienie zakażenia PRCV od TGE, dzięki obecności delecji w regionie genu S u PRCV. W celu wykrywania przeciwciał przeciwko TGEV metodami serologicznymi (ELISA) bada się surowicę świń, które wykazywały objawy chorobowe TGE przynajmniej tydzień wcześniej. Należy pamiętać, że powstawanie przeciwciał neutralizujących przeciwko TGEV może być także indukowane przez PRCV. Wzrost miana przeciwciał po ostrym okresie choroby przebiegającej ze wzrostem śmiertelności wśród prosiąt i nieżytem przewodu pokarmowego może świadczyć o infekcji TGEV lub PRCV. Przeciwciała neutralizujące przeciwko TGEV mogą być wykrywane nawet przez 18 miesięcy po zakażeniu.
Do testów serologicznych, które pozwalają na różnicowanie między zakażeniem PRCV i TGEV, należy test w formacie blokującym (bELISA), który wykorzystuje fragmenty antygenowe proteiny S nieobecne w przypadku PRCV. We własnym zakresie można przeprowadzić uproszczone badanie diagnostyczne polegające na ocenie stanu kosmków jelitowych pod mikroskopem lub silną lupą. Fragment jelita należy zanurzyć na szkiełku zegarkowym lub szalce Petriego w roztworze płynu fizjologicznego, a następnie ocenić stopień zniszczenia kosmków jelitowych. Przy TGE dochodzi do ich całkowitego zniszczenia. Badania histopatologiczne oraz izolacja wirusa i badania immunohistochemiczne, immunofluorescencja czy mikroskopia elektronowa mogą być również stosowane w diagnostyce TGE, jednak rzadko korzysta się z nich w praktyce (7, 33).
Leczenie
Nie opracowano dotychczas leku przeciwwirusowego przeciwko TGEV i jedynym rozwiązaniem jest leczenie objawowe i zapewnienie zwierzętom najlepszych warunków do wyzdrowienia. Podawanie płynów, elektrolitów i składników odżywczych pozajelitowo u świń jest niepraktyczne w warunkach fermowych, ale alternatywą może być podawanie płynów zawierających zbilansowany zestaw elektrolitów i glukozy doustnie. Konieczne jest zapewnienie warunków środowiskowych pozwalających na szybkie wyzdrowienie prosiąt: dodatkowego źródła ciepła dla osesków (pod którym temperatura wyniesie powyżej 32°C) oraz suchego i czystego kojca. W przypadku koinfekcji bakteryjnych wskazana jest antybiotykoterapia (7). Dopuszcza się także dostawianie prosiąt podatnych lub zainfekowanych TGEV do immunizowanych loch, których siara lub mleko zapewnią prosiętom odporność bierną (49).
Galeria
POSTĘPOWANIA
w weterynarii