Hemofilia typu A i B u psów
Hemofilia typu A i B występująca u psów jest najważniejszym dziedzicznym zakłóceniem przebiegu hemostazy wtórnej. Częstotliwość występowania hemofilii A jest blisko trzy do czterech razy wyższa niż hemofilii typu B (Brooks i wsp., 2003). U podłoża tych zaburzeń leży mutacja w obrębie genu czynnika VIII oraz czynnika IX (Brooks i wsp., 1997; Gu i wsp., 1999; Mischke, 2012; Alcaraz i wsp., 2013), co skutkuje brakiem bądź też dysfunkcją tych właśnie czynników (Brooks, 1999; Stokol, 2005) oraz spowolnieniem procesu tworzenia się skrzepu (Mischke, 2012).
Przedmiotowa publikacja koncentruje się na roli czynników VIII oraz IX w układzie krzepnięcia, molekularnych podstawach hemofilii typu A i B u psów oraz na objawach klinicznych i rozpoznawaniu tych dwóch postaci choroby.
Rola czynnika VIII oraz IX w układzie krzepnięcia
Znaczenie czynników VIII oraz IX w układzie krzepnięcia znajduje swe odzwierciedlenie w fakcie, że niski poziom czynnika VIII lub IX we krwi obwodowej utrudnia grupowanie układu wewnątrzpochodnego czynnika X oraz zakłóca przebieg kaskady reakcji w układzie krzepnięcia (Mann i wsp., 2003), prowadząc do rozwoju zaburzeń powiązanych z czynnikiem X, takich jak odpowiednio hemofilia A oraz B (Stokol, 2005; Brooks, 1999).
Czynnik VIII, będący glikoproteiną, krąży w osoczu w postaci nieaktywnego pro-kofaktora, tworząc niekowalencyjny kompleks z czynnikiem von Willebranda (Nichols i wsp., 1993; Sadler, 1998; Fay, 2004; Fay i wsp., 2005). U psów miejsce wiązania czynnika von Willebranda na czynniku VIII zawiera reszty aminokwasowe 1666 do 1676 w domenie A3 (Cameron i wsp., 1998). U tego gatunku czynnik von Willebranda stabilizuje strukturę czynnika VIII w osoczu (Turecek i wsp., 1997; Denis i wsp., 1999). Czynnik IX jest, dla odróżnienia, komponentem układu krzepnięcia zależnym od witaminy K (Mathur i wsp., 1997) i krążącym w osoczu jako jednołańcuchowy proenzym (Lacobelli, 2008).
W procesie krzepnięcia aktywacja czynnika IX przez kompleks czynnika VIIa i czynnika tkankowego (tromboplastyny tkankowej) następuje we wczesnym etapie tworzenia się fibryny (Osterud i wsp., 1977; Lawson i wsp., 1991), a kończy się wraz z zahamowaniem aktywności tego kompleksu przez szlak hamujący czynnika tkankowego (Monroe i wsp., 2007). W takiej sytuacji czynnik XIa uzupełnia aktywację czynnika IX (Mann i wsp., 2003; Smith i wsp., 2008). U psów miejsca aktywacji czynnika IX przeznaczone dla czynnika XIa zlokalizowano na Arg 146 – Ala 147 oraz Arg 178 – Val 179 w obrębie domeny peptydu aktywującego na cząsteczce czynnika IX (Axelrod i wsp., 1990).
W trakcie procesu krzepnięcia czynnik koagulujący VIII ulega aktywacji przez wcześnie wytworzoną trombinę w pętli dodatniego sprzężenia zwrotnego (Lane i wsp., 2005). Trombina jest niezwykle skutecznym aktywatorem czynnika VIII (Esmon i wsp., 1996). U psów trombina rozszczepia trzy wiązania peptydowe w miejscach Arg 366 – Ser 367, Arg 734 – Ser 735 oraz Arg 1681 – Ser 1682 w fazie aktywacji czynnika VIII (Cameron i wsp., 1998).
Po aktywacji obu czynników czynnik VIIIa tworzy kompleks określany jako wewnątrzpochodny kompleks czynnika X (Blostein i wsp., 2003) z czynnikami IXa oraz X, znajdującymi się na powierzchni aktywowanych płytek krwi (Lacroix-Desmazes i wsp., 2008). Aktywowane płytki krwi prezentują miejsca wiązania czynnika VIIIa (Ahmad i wsp., 2000), IXa (Ahmad i wsp., 1989) oraz X (Scandura i wsp., 1996; Ahmad i wsp., 2003A). Główną rolą kofaktora VIIIa w tymże kompleksie jest prezentowanie czynnika X czynnikowi IXa będącemu proteazą (Ahmad i wsp., 2003B) i katalizującemu proteolityczne przekształcenie czynnika X na czynnik Xa w obecności wapnia (Van Dieijen i wsp., 1981; Mathur i wsp., 1997).
Ponadto uważa się, że wewnątrzpochodny kompleks czynnika X jest odpowiedzialny za wytwarzanie przeważającej ilości czynnika Xa w kaskadzie reakcji krzepnięcia (Mann i wsp., 2003), będąc kluczowym elementem przebiegu tego procesu w miejscu uszkodzenia naczynia krwionośnego (Fay, 2004).
Poznane mutacje genu czynnika VIII oraz IX u psów
Podłoże molekularne hemofilii A oraz B jest odmienne u ludzi (Bowen, 2002) i u psów (Sugahara i wsp., 1996; Brooks i wsp., 1997; Gu i wsp., 1999, Mischke, 2012; Alcaraz i wsp., 2013) – fenotyp obu zaburzeń jest powodowany mutacyjną heterogennością pomiędzy rasami, a nawet w ich obrębie.
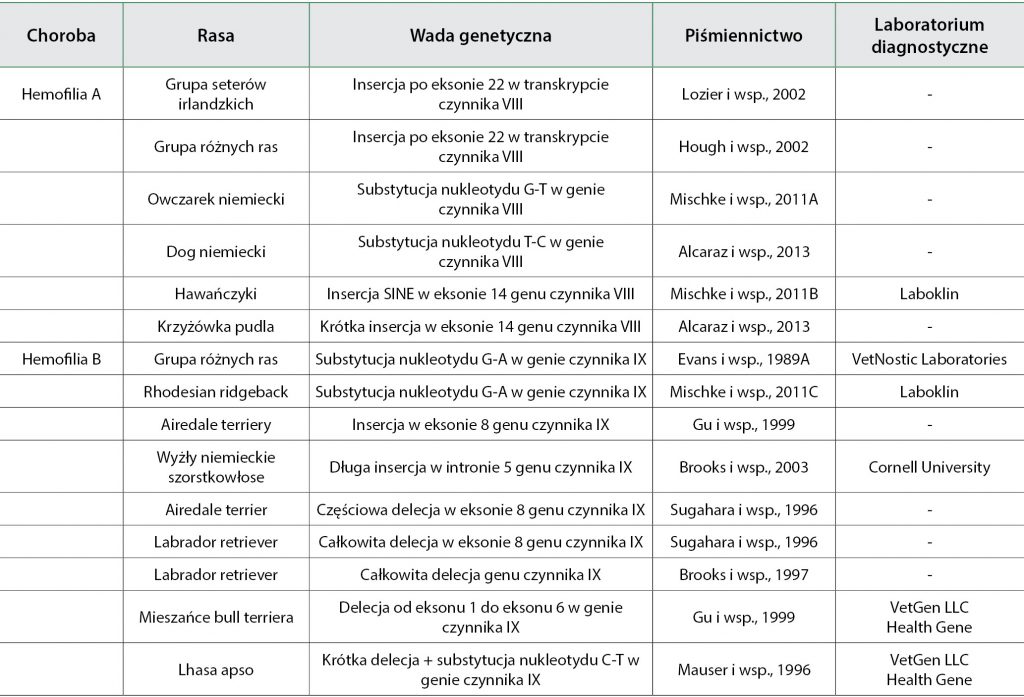
Wadę molekularną będącą przyczyną hemofilii A rozpoznano dotąd u pięciu różnych ras psów oraz u mieszańców (tab. 1, s. 16). Pierwszą opisaną mutację genu czynnika VIII u psów stwierdzono na Uniwersytecie w Północnej Karolinie w grupie seterów irlandzkich z hemofilią. U psów z ciężką postacią hemofilii stwierdzano wydłużenie parametrów czasu krzepnięcia oraz brak aktywności czynnika VIII. Analiza transkryptu czynnika VIII u psów z hemofilią wykazała nową sekwencję, nazwaną ch8 i zlokalizowaną po eksonie 22 transkryptu czynnika VIII.
Ch8 zbudowana była z sekwencji 421 nukleotydów, po której znajdowała się poliadenylowana sekwencja sygnałowa oraz ogona polyA i zawierała kilka kodonów stop. Analiza genomowego DNA zdrowych psów wykazała, że ch8 jest również zlokalizowany powyżej genu czynnika VIII. Obecność elementu DNA z końca 5’ położonego poniżej (w stronę końca 3’) eksonu 22 w transkrypcie czynnika VIII u psów z hemofilią sugeruje możliwość inwersji intronu 22 genu czynnika VIII u psów (Lozier i wsp., 2002).
Mogą zainteresować Cię również
POSTĘPOWANIA
w weterynarii
























