Kryptosporydioza u przeżuwaczy

Cryptosporidia to pierwotniaki odpowiedzialne za choroby przewodu pokarmowego (kryptosporydiozę) u wielu gatunków zwierząt stałocieplnych, w tym u człowieka i bydła. U człowieka C. hominis i C. parvum wywołują zapalenie jelit, a ten ostatni gatunek jest uważany za odzwierzęcy. Bydło może być nosicielem co najmniej pięciu różnych gatunków z rodzaju Cryptosporidium, a mianowicie: C. parvum, C. bovis, C. andersoni, C. ryanae i C. ubiquitum.
Ogólnie C. parvum należy uznać za najbardziej patogenny gatunek u przeżuwaczy ssących, podczas gdy inne gatunki są tylko sporadycznie związane z biegunką (Lendner i wsp., 2011). Niniejszy przegląd skupi się na C. parvum w kontekście przeżuwaczy, w szczególności cieląt.
Biologia
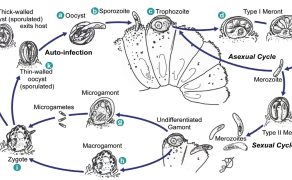
C. parvum nie jest ściśle przystosowany do konkretnego żywiciela i występuje u wielu ssaków, w tym u człowieka. Wydaje się jednak, że noworodki przeżuwaczy są szczególnie często dotknięte chorobą. Cykl życiowy C. parvum jest złożony (ryc. 1, CDC). Zakażenie rozpoczyna się od połknięcia zarodnikujących oocyst (droga fekalno-oralna). Transmisja może odbywać się bezpośrednio z żywiciela na żywiciela lub poprzez spożycie skażonej żywności lub wody.
Zarażeni żywiciele wydalają znaczną liczbę oocyst wraz z kałem. Na przykład zarażone cielęta mogą wydalić ponad 106 oocyst/g kału. Oocysty te są natychmiast zakaźne dla podatnych żywicieli i wystarczy niewielka dawka, aby wywołać chorobę. Eksperymentalnie ustalono, że średnia dawka zakaźna C. parvum potrzebna do wywołania biegunki i wydalania u 50% zwierząt (ID50) wynosiła zaledwie 16,6 oocyst (Zambriski, 2013). Oocysty są również bardzo odporne w środowisku. Mogą przetrwać ponad 6 miesięcy, jeśli warunki wilgotności i temperatury są sprzyjające (Fayer w Fayer i Xiao, 2007). Ponadto liczne środki dezynfekujące nie są aktywne wobec oocyst (patrz sekcja poświęcona dezynfekcji).
Po spożyciu oocyst sporozoity są uwalniane i szybko atakują rąbek szczoteczkowy nabłonka jelitowego. Indukują one tworzenie pasożytniczej wakuoli w obrębie rąbka szczoteczkowego poprzez manipulowanie rearanżacją cytoszkieletu (Ehrenman i in., 2013; Lendner i Daugschies, 2014) i nie przenikają przez błonę komórkową gospodarza – „lokalizacja wewnątrzkomórkowa, ale pozakomórkowa”. Ta niezwykła lokalizacja wewnątrzkomórkowa częściowo wyjaśnia obserwowany brak skuteczności wielu leków stosowanych w celu zabicia pasożyta (Mead, 2002). Podczas interakcji pomiędzy pasożytem a cytoplazmą żywiciela tworzy się unikalna, wysoce inwazyjna błona, „organella odżywiająca”. Ta specyficzna struktura powstaje w wyniku rearanżacji aktyny gospodarza w miejscu błony oddzielającej wakuolę pasożytniczą od cytoplazmy komórki gospodarza. Ponieważ kryptosporydiom brakuje wielu szlaków enzymatycznych, pasożyt jest całkowicie zależny od dostarczania składników odżywczych przez komórkę gospodarza za pośrednictwem tak zwanej organelli odżywiającej (Ehrenman i in., 2013; Lendner i Daugschies, 2014).
Pasożyt przekształca się w trofozoit, po czym następuje rozmnażanie bezpłciowe (merogonia, schizogonia). Od sześciu do ośmiu merozoitów powstałych podczas merogonii opuszcza wakuolę parazytoforową i atakuje sąsiednie enterocyty, gdzie inicjuje kolejny okres rozmnażania bezpłciowego (meronty II, z których każdy tworzy cztery merozoity), po którym następuje różnicowanie na samce (mikrogamont podzielony na 16 mikrogamet) oraz samice (jednokomórkowe makrogamonty/makrogametocyty) w stadium haploidalnym.
Po zapłodnieniu makrogametocytu przez mikrogametę powstaje diploidalna zygota, która zostaje otoczona ścianą cysty („oocysta”). Oocysta ulega sporulacji (sporogonii), w wyniku której powstają cztery haploidalne sporozoity. Niektóre ze sporulowanych oocyst wywołują autoinfekcję („cienkościenne oocysty”) jelita po pęknięciu cienkiej ściany oocysty, zanim pozostałe oocysty zostaną wydalone i natychmiast zainfekują kolejne komórki jelita, podczas gdy większość z nich jest wydalana z kałem i służy do zarażenia innych podatnych żywicieli („grubościenne oocysty”). Autoinfekcja sprzyja namnażaniu się pasożytów, a tym samym pogarsza zmiany patologiczne w jelitach i objawy kliniczne.
U cieląt okres prepatentny (od spożycia oocyst do ich wydalenia) wynosi 2-7 dni (ogólnie okres prepatentny wynosi 4-5 dni). Okres patentny (czas wydalania oocyst) jest zmienny, od 1 do 12 dni (Fayer w Fayer i Xiao, 2007).
Kluczowe punkty biologii C. parvum
- Zakażenie rozpoczyna się po spożyciu zarodnikujących oocyst (droga fekalno-orakna).
- Może być przenoszony bezpośrednio z żywiciela na żywiciela lub poprzez spożycie skażonej żywności lub wody.
- Zarażeni żywiciele wydalają znaczną liczbę oocyst z kałem, a oocysty są natychmiast zakaźne. Co więcej, oocysty są bardzo odporne na stres środowiskowy i wiele środków dezynfekujących.
- Sporozoity atakują rąbek szczoteczkowy komórek nabłonka jelitowego.
- Wszystkie stadia rozwojowe znajdują się w wewnątrzkomórkowych wakuolach pasożytniczych, ale poza cytoplazmą komórek żywiciela.
- U cieląt okres prepatentny wynosi 2-7 dni. Okres patentowy wynosi 1-12 dni.
Galeria
POSTĘPOWANIA
w weterynarii